|
DEVELOPPEMENT
Dans ce développement,
nous répondrons à notre problématique
:Quelles
informations peut-on obtenir de la lumière qu'un objet
émet ?
I)Les Spectres
lumineux
1)Les différents types de spectres
Spectre continu :
La lumière blanche est composé de toutes les
couleurs du spectre : on dit que la lumière blanche
possède un spectre continu car on passe d'une couleur
à l'autre progressivement sans interruption. Tout corps
solide ou tout corps gazeux sous forte pression, s'il est
à
haute température donne naissance à un spectre
continu
Spectre de raies d'émission
Certaines sources lumineuses n'émettent pas de spectre
continu, ceci est le cas d'un gaz chaud et peu dense. En analysant
la lumière émise par ce gaz à l'aide
d'un prisme, on observe des raies brillantes : ce spectre
est constitué de raies d'émission. Pour émettre
ce spectre, le gaz a absorbé de l'énergie. Il
ne possède pas toutes les couleurs ; chaque élément
chimique à l'état gazeux a son propre spectre
de raies. Ceci nous amène à dire
que le spectre de raies d'émission d'un gaz est "
son empreinte digitale ". La signature du
gaz est celle des atomes qui le constituent.
Spectre d'absorption
De même que les atomes peuvent rayonner de la lumière
sous forme d'un spectre d'émission, ils peuvent aussi
absorber de la lumière. Par exemple en faisant traverser
par une lumière blanche un gaz froid, le spectre se
trouve modifier : certaines couleurs ont disparu et l'on voit
des raies noires, appelées raies d'absorption, les
atomes ont absorbé sélectivement cette lumière.
La propriété importante de ce spectre de raies
d'absorption
est que ces raies se trouvent au même endroit que les
raies d'émission.
Pour illustrer ces spectres, des expériences seront
menées grâce à une fiche
matériel demandé.
A l'aide d'une lampe crate, on éclaire à travers
une fente puis une lentille pour obtenir une image nette sur
un écran puis on intercale entre la lentille et l'écran
un prisme ou un
prisme à vision directe. On observe ainsi un spectre
continu :

En remplaçant la lampe crate par une lampe à
vapeur de mercure on obtient un spectre d'émission
:

En réinstallant la lampe crate et en intercalant une
solution de permanganate de potassium entre la lentille et
le prisme on obtient un spectre d'absorption :

Les lois de Kirchhoff
Les lois qui décrivent les conditions de formation
de ces différents spectres portent le
nom du physicien Kirchhoff qui les publia en 1859 avec Bunsen
:
Un gaz à pression élevée, un liquide
ou un solide, s'il est chauffé, émet un rayonnement
continu qui contient toutes les couleurs.
Un gaz chaud, à basse pression, émet un rayonnement
uniquement pour certaines
couleurs bien spécifiques : le spectre de ce gaz présente
des raies d'émission
Un gaz froid, à basse pression, s'il est entre l'observateur
et une source de rayonnement continu, absorbe certaines couleurs,
produisant ainsi un spectre de raies d'absorption.
Ce gaz absorbe les mêmes couleurs qu'il émettrait
s'il était chaud.
On peut se demander comment se forme le spectre de raies
2) Formation du spectre de raies
La première condition pour qu'une raie spectrale,
caractéristique d'un élément chimique,
puisse se former est évidemment que cet élément
chimique soit présent.
Ensuite lorsqu'un gaz est chauffé, l'élévation
de température augmente l'agitation des
atomes qui se heurtent plus fréquemment et plus violemment.
Lors de ces chocs,
l'énergie acquise se traduit par une perturbation du
cortège électronique, les atomes recevant un
supplément d'énergie qui les placent à
un niveau d'énergie supérieur.

Ils sont excités, leurs électrons sont moins
liés. Après le choc, l'atome se désexcite,
les électrons " redescendent " à leur
niveau d'origine, et l'atome retrouve son énergie initiale.
La différence d'énergie est libérée
sous forme d'émission lumineuse, le photon. C'est une
particule immatérielle et sans masse. Chaque photon
d'un rayonnement (lumière, ondes radios, rayons X...)
est porteur d'un quantum d'énergie caractéristique
de sa fréquence (fréquence de la lumière
= couleur).
Prenons l'exemple de l'hydrogène qui est l'atome le
plus simple et le plus présent dans l'univers.
L'atome d'hydrogène peut absorber ou émettre
des quantités (ou quantum) d'énergie
bien particulières : celles qui correspondent au passage
de l'atome d'un niveau excité par une énergie
En à un niveau plus bas, caractérisé
par une énergie Ep inférieure à En se
fait avec émission de la différence d'énergie
En-Ep.
L'atome peut émettre un photon dont l'énergie
est égale à la différence d'énergie
entre
les deux niveaux. Cette énergie correspond à
une onde électromagnétique de fréquence
v ou de longueur d'onde l=c/l. Elle peut être déterminée
selon la formule de Planck :
E=h.v ou E= h.c/l où :
-H est le facteur de proportionnalité et est appelé
la constante de Planck. Il vaut aux alentours de 6,6260755xlO-34
(exprimée en J.S)
-E étant la quantité ou quantum d'énergie
(en J)
-v la fréquence (en Hz)
-c étant la célérité (en m/s)
-l étant la longueur d'onde (en m)
L'atome peut aussi absorber de l'énergie, ceci lui
permettant de passer d'un niveau
inférieur à un niveau supérieur, par
exemple en absorbant un photon. Mais ceci n'est possible que
si le photon possède exactement l'énergie nécessaire,
c'est-à-dire la
différence d'énergie entre le niveau d'arrivée
et le niveau de départ.
L'état stable d'un atome est son niveau d'énergie
fondamental. Lorsqu'un atome est
porté dans un niveau excité, il n'y reste pas
longtemps. Il revient à son niveau
fondamental en émettant un photon de longueur d'onde
correspondante à la variation d'énergie de cette
transition.
Série ; Première raie ; Limite ; Domaine
Lyman ; 0,1215 mm ; 0,0911 mm ; Ultraviolet
Balmer ; 0,6570 mm ; 0,3647 mm ; Visible
Paschen ; 1,875 mm ; 0,820 mm ; Infrarouge
Bracket ; 4,050 mm ; 1,458 mm ; Infrarouge
Pfund ; 7,409 mm ; 2,278 mm ; Infrarouge
3)Données obtenues à partir de l'analyse
d'un spectre
Si l'on observe des raies caractéristiques d'un élément
chimique dans le spectre d'un
corps, cela signifie qu'il y'a certainement cet élément
chimique dans le corps. Lorsqu'un
gaz est formé de plusieurs éléments chimiques
différents, le spectre est plus complexe.
On peut cependant identifier chacun de ces éléments
si on connaît bien les spectres des différents
éléments chimiques présents dans la nature.
Lorsque que chaque raie a été identifiée,
on a déterminé la composition chimique d'un
gaz. Grâce à ce procédé, on
peut déterminer la composition chimique d'astres qui
sont très éloignés.
La température d'une étoile dépend de
l'étendue de son spectre. Prenons une lampe à
incandescence :
Plus le courant électrique est grand, plus la lampe
brille. Au début la lumière est rouge
puis va de plus en plus vers le bleu. Plus la température
du filament augmente, plus le spectre d'étend et dévie
vers le bleu. Ainsi on peut classer les étoiles selon
leur
température de surface et leur couleur.
Il est possible de déterminer la proportion d'atomes
occupant l'état d'énergie qui correspond au
niveau de départ de la transition produisant cette
raie et ainsi obtenir un deuxième indicateur de température.
A mesure que la température croît, la proportion
d'atomes excités au niveau n=2 par rapport au nombre
total d'atomes et d'ions
commence d'abord par augmenter puis diminuer. L'intensité
des raies de la série de
Balmer de l'hydrogène passe par un maximum pour une
température voisine de 10000K. Cette intensité
est donc un indicateur de la température qui règne
dans le milieu où se
sont formées ces raies.
Pour déterminer l'abondance de l'élément,
c'est très simple : pour une température
donnée, une raie est d'autant plus intense que l'élément
chimique qui la caractérise est
plus abondant.
Ces études permettent de déterminer de nombreux
renseignements sur les astres,
comme par exemple le Soleil
II) Application
de la spectroscopie à l'étude de la composition
chimique et de la température du soleil
Le spectre solaire peut s'obtenir simplement, en orientant
un prisme ou un spectroscope, appareil à prisme ou
à réseau permettant aussi de décomposer
la lumière vers le ciel,
vers une région bien éclairée, à
proximité du soleil. Cette observation nous permet
d'obtenir le spectre ci-après:
spectre solaire
On observe sur ce spectre des raies dites d'absorption, telles
que nous en avons étudiées dans la partie précédente.
Ces raies sont donc la signature des différents éléments
chimiques constitutifs du soleil. Parmi ces raies il y en
a cependant certaines qui ne sont
pas dues à l'atmosphère solaire, mais à
l'atmosphère terrestre. Tels que cette bande
de l'oxygène, dans la partie rouge du spectre
Pour déterminer expérimentalement la composition
de notre étoile, nous allons repérer
sur le spectre
visible du soleil les quinze principales raies, et afin
de connaître les
longueurs d'onde de ces raies nous allons y juxtaposer le
spectre d'un élément chimique déjà
étudié au préalable, ici, le spectre
de l'argon, où nous avons marqué des valeurs
des longueurs d'onde de ses raies caractéristique.
Nous avons le tableau ci-après.
Il ne reste alors qu'à comparer nos résultats
avec les valeurs des longueurs d'onde l de différents
éléments chimiques connues répertoriées
dans le tableau ci-après.
De cette étude expérimentale, nous mettons
en évidence que le soleil contient du Ca,
du H, du Fe, du Ti, et du Mg.
Les recherches scientifiques ont permis de connaître
avec exactitude la composition chimique de notre étoile
qui est récapitulée dans ce tableau :
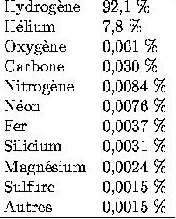
L'étude du spectre solaire permet aussi
de déterminer la température du soleil en surface
grâce à la loi de Wien, en effet, plus un objet
est chaud, plus il émet de lumière dans les
courtes longueurs d'onde. Ainsi, un métal peu chauffé
émet dans le rouge. Il émet de
plus en plus vers le bleu quand sa température augmente,
et finit par être perçue comme blanche. Ainsi,
on a l'égalité suivante : lm*T=2900 mm*K
Le spectre continu de la lumière du soleil présente
un maximum d'intensité lumineuse
dans le vert comme le montre la courbe ci-dessous :

Le maximum de luminescence se situe donc dans le vert aux
environs de 480 nm. L'application de la loie de Wien donne
environ T=6000 K.
La température de surface du soleil avoisine donc les
6000 Kelvins.
Le spectre lumineux peut enfin montrer la rotation du soleil,
notamment par l'étude de
l'effet Doppler-Fizeau que nous allons maintenant aborder.
Haut de page
III) L'Effet
Doppler-Fizeau
A) Présentation de l'Effet Doppler-Fizeau
1) Historique
C'est le physicien autrichien Christian DOPPLER qui expliqua
en 1842 que notre perception de la hauteur d'un son est altérée
par le mouvement relatif de la source sonore par rapport à
l'observateur.
15 trompettistes furent placés dans un train et les
expérimentateurs se placèrent au
bord de la voie. Quand le train arriva, les trompettes retentirent
et la hauteur des sons
émis sembla diminuer quand le train fut passé,
comme l'avait prédit la théorie de DOPPLER.
Il suggéra alors que les couleurs des étoiles
pourraient être dues à un effet de ce type, affectant
leur lumière. Mais en 1848, le physicien français
Hippolyte. FIZEAU montra
que les vitesses des étoiles sont beaucoup trop faibles
par rapport à la vitesse de la
lumière pour provoquer une modification appréciable
de leurs couleurs. Il en conclut que l'on pouvait en revanche
espérer détecter de faibles variations de longueurs
d'ondes des raies dans leurs spectres. Cette conclusion fut
vérifiée avec succès par l'astronome
anglais W. HUGGINS en 1868.
2) Vérification expérimentale
Nous savons qu'il existe une similitude entre la propagation
des ondes sonores et électromagnétiques. Une
modélisation de l'effet DOPPLER-FIZEAU pourra donc
se restreindre à l'observation de la propagation d'ondes
sonores.
Ainsi, cette modélisation consistera en la mise en
rotation d'un buzzer ou d'une
quelconque source d'émission sonore constante.
Aussi, pour faciliter la compréhension du phénomène,
il m'est possible de donner
l'exemple de " la voiture qui passe".
3) Explication du principe
En fait, cette altération de notre perception résulte
de la compression et de la décompression des ondes,
une conséquence du mouvement relatif de la source par
rapport à l'observateur.
-Quand une source se rapproche de l'observateur, il y a une
compression des ondes ; la longueur d'ondes est plus courte.
-Par contre, quand une source s'éloigne d'un observateur,
il y a une décompression des ondes ; la longueur d'ondes
est plus longue.
Ce qui est vrai pour le son est vrai pour la lumière
: le grave correspond au rouge, l'aigu
au bleu. En fait, cette variation de longueur d'ondes est
une variation de périodes : la période d'une
onde est la durée qui sépare deux passages successifs,
par exemple de
son maximum, en un point fixe donné.
Si un observateur en mouvement cherche à mesurer cette
durée, il lui trouve une valeur différente,
plus élevée s'il se déplace dans le sens
de l'onde, plus courte s'il se déplace en sens contraire.
D'une manière générale, l'effet DOPPLER-FIZEAU
modifie la période
d'un signal périodique.
B)Une source d'information majeure en astronomie
1)L'effet DOPPLER-FIZEAU en spectrohéliographie.
L'effet DOPPLER permet de mettre en évidence la rotation
solaire par spectroscopie.
En effet, le soleil étant en rotation, le gaz au limbe
est se dirige vers nous tandis que le
gaz au limbe ouest s'éloigne de nous.
Le principe de cette expérience consistait à
prendre un spectre au limbe ouest et un
autre au limbe est pour mettre en évidence cet effet.
Ainsi, une dispersion suffisante du spectroscope doit donc
nous permettre d'observer
un décalage des longueurs d'onde.
2)L'effet DOPPLER-FIZEAU en spectroscopie.
L'effet DOPPLER-FIZEAU joue un rôle très important
en astrophysique car les astres
sont animés de vitesse les uns par rapport aux autres.
La vitesse est une notion essentiellement relative et quand
on parle de mesurer la vitesse d'une étoile, il s'agit
de la vitesse qu'elle a par rapport à l'observateur.
On utilise pour ce faire la propriété qu'a la
lumière de changer de couleur suivant que la source
lumineuse s'éloigne ou s'approche de l'observateur
: bleue si elle a un mouvement d'approche, rouge si elle s'éloigne
de nous.
Le spectre d'une étoile qui s'approche de l'observateur
est décalé vers le bleu (vers les faibles longueurs
d'onde), et celui d'une étoile qui a un mouvement de
récession subit un décalage vers le rouge (vers
les grandes longueurs d'onde "redshift").
Il est donc possible à partir de ce décalage
de déduire la vitesse radicale des étoiles :
la valeur de ce décalage est proportionnelle à
la vitesse de l'étoile, plus précisément
à la composante de sa vitesse qui traduit l'approche
ou l'éloignement, que l'on nomme vitesse radicale.
Ainsi les astrophysiciens ont abouti à la relation
suivante :
?v = Vr / c
?v= Décalage relatif de la longueur d'onde.
Vr= vitesse radicale de la source.
C= vitesse de la lumière.
Ce calcul montre que le décalage relatif de la longueur
d'onde est proportionnel au
rapport de la vitesse de la source par rapport à l'observateur
à la vitesse de la lumière.
Mais il est également possible d'en déduire
des informations concernant l'agitation
thermique de la source émettrice.
En effet, la source de lumière est constituée
de particules animées de vitesses différentes
les unes des autres ; l'effet DOPPLER-FIZEAU provoque un élargissement
des raies spectrales observées. Les atomes sont animés
de mouvements aléatoires dus à la température
: Plus la température est élevée et plus
ces mouvements sont importants,
donc plus l'éventail des longueurs d'onde observées
est grand. La raie est donc d'autant
plus élargie que la température est plus élevée.

Le Soleil étant en rotation, le gaz au limbe Est se
dirige vers nous tandis que le gaz au
limbe Ouest s'éloigne de nous. En prenant un spectre
au limbe Ouest et un autre au limbe Est, on doit donc pouvoir
observer un décalage des longueurs d'onde si la dispersion
du spectroscope est suffisante.
Les spectres sont obtenus en positionnant successivement la
fente du spectro aux limbes
Est et Ouest.
En valeurs arrondies, le soleil effectue une rotation en 25
jours à l'équateur, et un point de son équateur
parcours 4.4 millions de km pendant cette durée. La
vitesse à mesurer est donc de l'ordre de 2 km/s. Cette
vitesse doit se traduire par un décalage Doppler de
589*2/300000 = 0.0039 nm pour la raie jaune du Sodium. Cela
représente donc un
écart de 0.0078 nm entre les spectres Est (décalage
vers le bleu) et Ouest (décalage
vers le rouge).
L'essai que j'ai réalisé donne une valeurs
tout à fait comparable et confirme ainsi le bon fonctionnement
de mon spectro.
La valeur mesurée du décalage entre les raies
obtenues sur les bords Est et Ouest du
Soleil est effectivement d'environ 0,0075 nm. Remarquez les
raies dues à l'atmosphère terrestre ( indiquées
par "T") qui ne subissent pas ce décalage.

3)Une source d'information clef pour déduire l'évolution
de l'univers.
La loi Hubble fut établie par l'astronome américain
Edwin HUBBLE en 1929 en étudiant
un grand nombre de spectres de galaxies. Cette étude
montra que la quasi-totalité des galaxies observées
présentent des raies d'absorption décalées
vers la partie rouge de leur spectre et par conséquent
s'éloignent de la terre.
HUBBLE montra que la vitesse de récession des galaxies
est d'autant plus importante qu'elles sont éloignées
par rapport à nous.
Quelle que soit l'interprétation que l'on donne à
cette loi, elle montre que l'univers évolue
et s'oppose à l'idée ancienne d'un univers statique.
La découverte d'Edwin HUBBLE, à savoir que l'ensemble
des galaxies, c'est-à-dire l'univers entier est en
expansion, bouleversa les théories cosmologiques de
l'époque. Ce phénomène amenait tout de
suite à se poser deux questions concernant d'une part,
la création de l'univers et d'autre part son évolution.
L'analyse spectrale nous a donc permis de mettre en évidence
l'évolution de l'univers, son expansion, constituant
ainsi une preuve à la théorie du "big-bang".
Haut de page
Copyright@Skwi
|